1983年,外泌体首次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。 外泌体是指包含了复杂RNA 和蛋白质的小膜泡(30-150nm),现今,其特指直径在40-100nm的盘状囊泡。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中 。
所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。外泌体携带大量特异性的蛋白质(如细胞因子、生长因子)以及功能性的mRNA、miRNA等生物活性物质,在体内参与免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭、促血管新生等生理过程,与多种疾病的发生和进程密切相关。
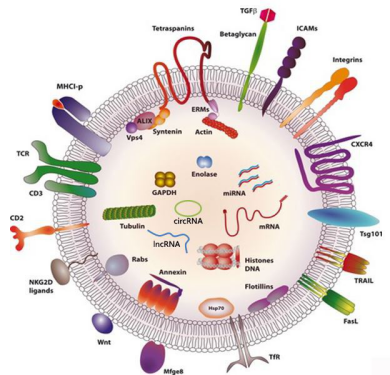
外泌体模式图
分离外泌体的方法
外泌体样本的主要来源有细胞培养上清、血清/血浆、尿液、腹水、乳汁、脑脊液、唾液、滑液等,如果是使用细胞培养上清,要注意细胞培养中不能添加FBS,因为血清本身含有外泌体颗粒。
外泌体分离方法有很多种,包括超速离心、过滤离心、密度梯度离心、免疫磁珠和商用试剂盒。目前研究通常选用超速离心法进行外泌体的提取和分离,超速离心方法得到的外泌体是得率与纯度都比较好。
外泌体超速离心提取、密度梯度离心
案例分析:
1、外泌体提取与鉴定
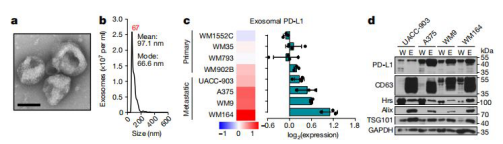
图1.外泌体电镜、粒径与内含RNA、蛋白鉴定
2、外泌体功能验证
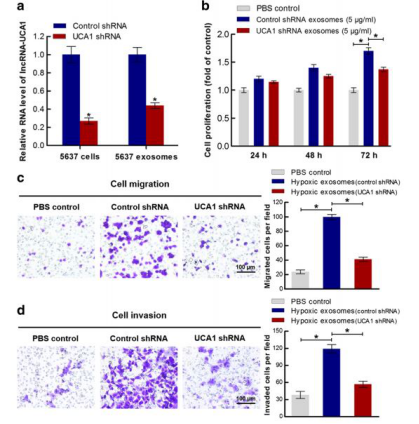
图2.外泌体介导lncRNA发挥作用,影响细胞表型
3、外泌体测序及组学研究
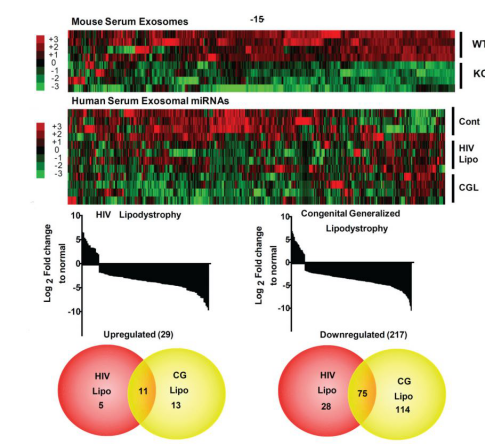
图3.外泌体miRNA测序
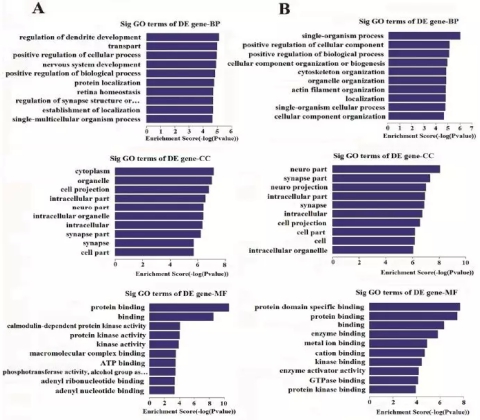
图4.差异表达miRNA来源基因GO分析和KEGG通路富集分析
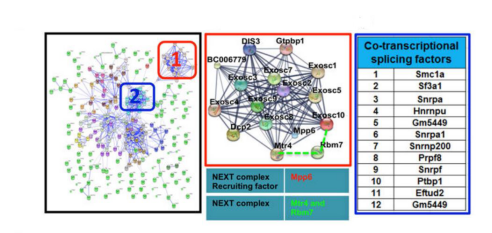
图5.差异表达miRNA来源基因网络分析
4、外泌体细胞uptake实验。
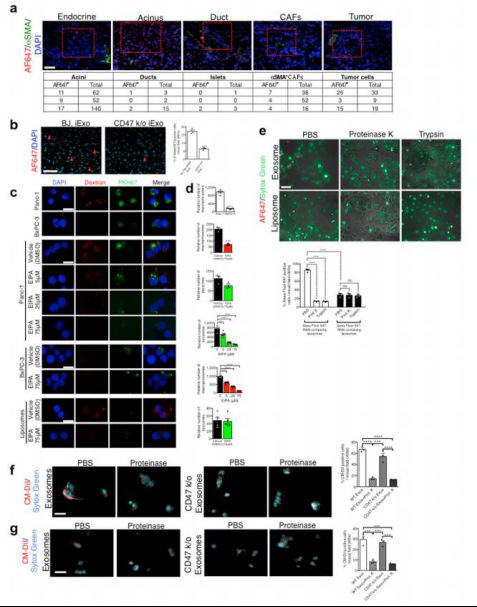
图6.胰腺定位的外泌体进入肿瘤细胞
5、外泌体动物实验-构建裸鼠移植瘤模型
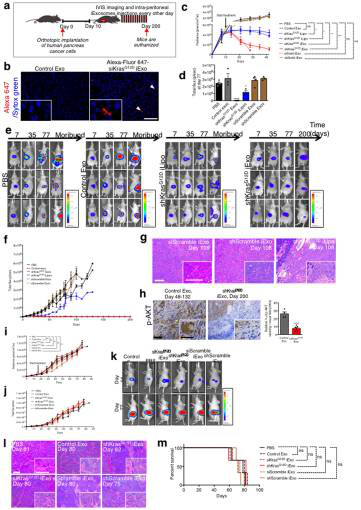
图7.含有KrasG12D RNAi的外泌体抑制Panc-1原位肿瘤生长
参考文献
1. Chen, G., et al., Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature, 2018. 560(7718): p. 382-386.
2. He, C., et al., Exosome Theranostics: Biology and Translational Medicine. Theranostics, 2018. 8(1): p. 237-255.
3. Kamerkar, S., et al., Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature, 2017. 546(7659): p. 498-503.
4. Li, P., et al., Progress in Exosome Isolation Techniques. Theranostics, 2017. 7(3): p. 789-804.
5. Lim, J., et al., Nuclear Proximity of Mtr4 to RNA Exosome Restricts DNA Mutational Asymmetry. Cell, 2017. 169(3): p. 523-537 e15.
6. Nabet, B.Y., et al., Exosome RNA Unshielding Couples Stromal Activation to Pattern Recognition Receptor Signaling in Cancer. Cell, 2017. 170(2): p. 352-366 e13.